2 Закономерности
формирования структуры металлов и сплавов
2.1. Кристаллизация
и строение литого металла
Движущая сила кристаллизации. Кинетика
кристаллизации. Зарождение центров кристаллизации. Критический зародыш. Гомогенное зарождение.
Рост кристаллов. Гетерогенное
зарождение. Форма и размер кристаллов.
Кристаллизацией называется процесс образования твердых кристаллов из жидкости или газа. Переход вещества из одного агрегатного состояния в другое является фазовым превращением.
Фазой называется химически и физически однородная часть вещества (или системы), отделенная от других ее частей поверхностью раздела, при переходе через которую состав, структура или свойства изменяются скачкообразно.
Процесс кристаллизации, как и всякое фазовое превращение,
происходит самопроизвольно. Движущей силой кристаллизации является
понижение свободной энергии системы. Если система может существовать в жидком и
кристаллическом состоянии, то взаимосвязь свободной энергии от температуры F=U
-TS имеет вид, представленный на рисунке 2.1. Кривая 1 описывает
зависимость свободной энергии от температуры для жидкой фазы, а кривая 2 - для кристаллической.
Температура То, при которой свободные энергии вещества в жидком и
твердом состоянии равны, является теоретической температурой кристаллизации.
При температуре выше То устойчива  жидкая фаза, а
ниже - кристаллическая фаза. Однако при этой температуре обе фазы устойчивы,
следовательно, кристаллизация не может
начаться, так как нет движущей силы. Более того, при случайном превращении
жидкости в кристалл, появляется граница раздела фаз и энергия системы
повышается на величину D f пов =S s, где S - площадь поверхности
кристаллика (6 а2), s - удельная поверхностная энергия
на границе жидкой и кристаллической фаз.. Кристаллизация начнется тогда, когда
свободная энергия кристаллической фазы будет меньше свободной энергии жидкой
фазы, т.е. при температуре ниже теоретической. При этом произойдет
самопроизвольное уменьшение энергии на величину DF = Fж - Fкр
на единицу объема вещества. Разность между теоретической и действительной
температурами DТ=То-Т называется степенью
переохлаждения, при наличии которой может начаться зарождение
центров кристаллизации.
жидкая фаза, а
ниже - кристаллическая фаза. Однако при этой температуре обе фазы устойчивы,
следовательно, кристаллизация не может
начаться, так как нет движущей силы. Более того, при случайном превращении
жидкости в кристалл, появляется граница раздела фаз и энергия системы
повышается на величину D f пов =S s, где S - площадь поверхности
кристаллика (6 а2), s - удельная поверхностная энергия
на границе жидкой и кристаллической фаз.. Кристаллизация начнется тогда, когда
свободная энергия кристаллической фазы будет меньше свободной энергии жидкой
фазы, т.е. при температуре ниже теоретической. При этом произойдет
самопроизвольное уменьшение энергии на величину DF = Fж - Fкр
на единицу объема вещества. Разность между теоретической и действительной
температурами DТ=То-Т называется степенью
переохлаждения, при наличии которой может начаться зарождение
центров кристаллизации.
Рисунок 2.1. Зависимость свободной энергии от температуры для жидкой и кристаллической фазы
Д.К.Чернов установил, что механизм кристаллизации заключается в образовании центров кристаллизации и росте кристаллов из образовавшихся центров. Количественно кинетика процесса описывается скоростью зарождения центров кристаллизации (с.з.ц.) - числом центров кристаллизации, возникающих в единице объема за единицу времени, и линейной скоростью роста кристаллов (л.с.р.) - скоростью перемещения какой-либо грани кристалла параллельно самой себе. Рассмотрим эти два процесса.
Зарождение центров кристаллизации.
Тепловое движение атомов приводит к тому, что в жидкости постоянно образуются и разрушаются группы атомов с упорядоченным строением. При охлаждении жидкой фазы ниже температуры То, некоторые наиболее крупные из них могут стать устойчивыми. Они и являются самопроизвольно возникшими зародышами или центрами кристаллизации. Однако не все зародыши могут расти, способными к росту становятся кристаллы только достаточно большого - критического размера. Пусть в системе зарождается один центр кристаллизации в виде кубика с ребром а, это приведет к уменьшению объемной свободной энергии на величину
D f об = V D F (1),
где V объем кристаллика, равный а3. Образование кристаллика сопровождается возникновением поверхности раздела между жидкой фазой и кристаллом, и работа, затраченная на ее создание равна
D Fпов =S s (2),
где S - площадь поверхности кристаллика (6 а2), s - удельная поверхностная энергия на границе жидкой и кристаллической фаз. Следовательно, общее изменение свободной энергии системы будет
D F =D F об + D F пов (3) или
D F = а3. D F + 6 а2 s (4).
Для данной температуры D F и s величины постоянные, и D F зависит лишь от размера кристаллика. Дифференцируя уравнение (4) получаем:
dD F / da =
3a2 D F +12as
.
Отсюда следует, что D f имеет максимум при
акр=4s /D F (5),
и кристаллик размером акр называется критическим зародышем. Он находится в неустойчивом равновесии с исходной фазой: как его рост, так и распад вызывают уменьшение свободной энергии системы. Кристаллы размером более акр способны к росту, при этом свободная энергия системы будет уменьшаться. Размер критического зародыша уменьшается по мере увеличения степени переохлаждения.
Образование критического зародыша обеспечивается за счет флуктуации энергии, и такой процесс называют гомогенным зарождением. Чем больше степень переохлаждения, тем меньше критический зародыш и тем меньше работа его образования. Поэтому увеличивается число критических зародышей, возникающих в единице объема за единицу времени. Их число пропорционально exp (-D fкр/kT). Вместе с тем, увеличение степени переохлаждения привод к тому, что подвижность атомов снижается, и вероятность образования устойчивого зародыша кристалла снижается. Таким образом, при увеличении степени переохлаждения с.з.ц. сначала возрастает, проходит через максимум и снижается. При температурах, когда диффузионные процессы не могут происходить, центры кристаллизации не образуются, и вещество переходит в аморфное состояние. Теоретические расчеты показывают, что максимальные значения с.з.ц. достигаются при 0,2 То.
Экспериментально установлено, что кристалл может расти лишь путем
одновременного присоединения определенной группы атомов на какую-либо грань.
Такая группа атомов называется двумерным зародышем.
Следовательно, скорость роста кристаллов определяется вероятностью зарождения
двумерного зародыша и вероятностью его присоединения к кристаллу за счет
диффузии. Отсюда следует, что степень
переохлаждения влияет на линейную скорость
роста (л.с.р.) аналогично тому, как она влияет на скорость зарождения центров (с.ц.з.).
Экспериментально  установлено,
что максимум Л.С.Р. чаще всего соответствует меньшим степеням переохлаждения,
чем максимум С.З.Ц.
установлено,
что максимум Л.С.Р. чаще всего соответствует меньшим степеням переохлаждения,
чем максимум С.З.Ц.
Кривые на рисунке 2.2 называются кривыми Таммана, который впервые построил
их экспериментально в 1935 году. На основе их анализа можно сделать вывод, что
Л.С.Р. и С.З.Ц. являются функцией степени переохлаждения, которая в свою
очередь зависит от скорости охлаждения - чем больше скорость охлаждения, тем
большего переохлаждения можно достигнуть. Следовательно, изменяя условия
охлаждения, можно управлять процессом кристаллизации.
Конечный размер зерен определяется числом центров и скоростью роста. Число
зерен (кристаллов) в единице объема может быть определено как n= (С.З.Ц./
Л.С.Р. )1/ 2
Рисунок 2.2. Зависимость параметров кристаллизации от степени переохлаждения
Факторы, влияющие на процесс кристаллизации
Как было показано, работа образования критического зарождения определяется величиной поверхностной энергии на границе между жидкой и кристаллической фазой. В связи с этим все факторы, влияющие на поверхностную энергию, влияют на кинетику кристаллизации. Наличие готовых поверхностей раздела облегчает процесс зарождения кристаллов. Реальные металлы всегда содержат большое количество примесей, мельчайшие частицы нерастворимых фаз, окислов, что приводит к сильному ускорению образования зародышей и кристаллизации в целом. Кристаллизация в присутствии готовых поверхностей раздела называется гетерогенным зарождением. Стенки форм, в которую отливают жидкий металл, также служат готовой поверхностью раздела. Наличие теплоотвода через стенки формы способствует увеличению степени переохлаждения.
Ряд механических свойств металлов, как прочность, пластичность, выносливость, ударная вязкость тем выше, чем меньше размер зерен. Поэтому в практике изготовления отливок, особенно если они не подвергаются дальнейшей обработке давлением, применяют модифицирование - введение в расплав специальных добавок, которые, не изменяя химического состава, создают дополнительные центры кристаллизации, тем самым измельчают структуру.
В идеальном случае при очень малых степенях
переохлаждения вырастает кристалл равновесной формы. В реальных металлах и
сплавах форма и размеры кристаллов зависят от ряда факторов: кристаллического
строения, скорости роста, направленности теплоотвода. Обычно кристаллы зарождаются
правильной геометрической формы, соответствующей их кристаллическому строению.
Если скорость роста кристалла одинакова во всех направлениях, кристаллы растут,
сохраняя правильную форму, до тех пор, пока его окружает со всех сторон жидкая
фаза. В условиях значительного переохлаждения элементы огранки кристалла будут
в неодинаковом положении по отношению питания из жидкой фазы. Лучше всего
питание подводится к вершинам, затем к ребрам, и, наконец, к граням
многогранника, что вызывает неравномерный рост кристалла, приводя к образованию
скелетных, игольчатых, спиральных и других форм. Если скорость роста кристаллов
в одном направлении больше, образуются кристаллы древовидной формы, или дендриты (рисунок 2.3 а). Сначала кристалл
приобретает вытянутую форму в направлении большей скорости роста, затем
начинает расти в боковых направлениях, причем не по всей поверхности, а на
отдельных участках. В результате от основной оси первого порядка,
соответствующей направлению наибольшей скорости роста, ответвляются оси второго
порядка и т.д. Дендриты растут до тех пор, пока не соприкоснутся друг с другом.
После этого кристаллизуются междендритные пространства, и дендриты превращаются
в кристаллы. Кристаллы или зерна могут состоять из нескольких одинаково  ориентированных
дендритов.
ориентированных
дендритов.
Металлические слитки, получаемые в промышленных условиях, обычно состоят из трех зон (рисунок 2.3 б). В наружном слое при контакте жидкого металла со стенками формы возникает высокая степень переохлаждения, ведущая к образованию большого числа центров кристаллизации, поэтому наружный слой имеет мелкозернистое строение. После образования наружного слоя скорость охлаждения, соответственно и DТ, уменьшается, уменьшается число центров и скорость роста. Однако Л.С.Р. уменьшается в меньшей степени, и в условиях направленного теплоотвода образуется вторая зона - столбчатых кристаллов, имеющих дендритное строение. В центре слитка DТ обычно невелика, направленного теплоотвода нет, образуется зона крупных равноосных зерен, имеющих также дендритное строение.
Рисунок 2.3. Схема роста дендрита (а) и строения слитка: 1- зона мелких кристаллов, 2-зона столбчатых кристаллов, 3- зона равноосных кристаллов.
2.2 Основные типы диаграмм двухкомпонентных систем
Диаграмма состояния с неограниченной растворимостью компонентов в твердом состоянии.
Диаграмма состояния с полной
нерастворимостью компонентов в твердом состоянии и образующих эвтектику.
Диаграмма состояния с образованием устойчивого
химического соединения.
Связь свойств сплавов с типом диаграмм состояния.
Диаграммы состояния, или диаграммы фазового равновесия, представляют собой графическое изображение всех превращений, протекающих в сплавах в зависимости от температуры и концентрации компонентов. То есть, диаграмма строится в координатах концентрация – температура. Превращения в сплавах при нагреве или охлаждении зависят от того, какие фазы при этом образуются. Так, однородная жидкость представляет собой однофазную систему, а жидкий сплав и находящиеся в нем кристаллы или смесь кристаллов двух видов - двухфазную систему.
Система может состоять из одного или нескольких компонентов, например, система медь-никель состоит из двух компонентов: меди и никеля.
Рассмотрим наиболее часто встречающиеся типы диаграмм состояния двойных сплавов: 2) при неограниченной растворимости компонентов друг в друге в твердом состоянии; 1) при ограниченной растворимости компонентов друг в друге и образующих граничные твердые растворы и эвтектику; 3) с образованием химического соединения.
Диаграммы состояния двойных сплавов
строят в двух измерениях: по оси ординат откладывают температуру, а по оси
абсцисс - концентрацию компонентов. Общее содержание двухкомпонентного сплава в любой точке абсциссы равно 100%, а
крайние ординаты соответствуют чистым компонентам. Каждая точка на диаграмме
состояния показывает состояние сплава данной концентрации при данной
температуре и называется фигуративной точкой.
Правило фаз. Различные изменения системы, происходящие в зависимости от внешних условий (например, температуры), подчиняются правилу фаз. Оно устанавливает зависимость между числом компонентов, числом фаз и числом степеней свободы системы. Под числом степеней свободы (вариантность) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменить без изменения числа фаз данной системы.
Правило фаз для металлических систем при постоянном давлении выражается уравнением
С
=К+ 1 -Ф,
где С - число степеней свободы системы; К- число компонентов, образующих систему; Ф - число фаз, находящихся в равновесии; 1 - число внешних переменных факторов (температура)
В процессе затвердевания чистого металла (К=1, Ф=2)- система нонвариантная (безвариантная), так как, согласно приведенной формуле, С=0. В системе нельзя произвольно изменять внешний фактор (температуру), не изменяя числа фаз и равновесия системы.
Чистый расплавленный металл (К=1, Ф=1) представляет моновариантную (одновариантную) систему с одной степенью свободы (С=1). Сохраняя металл в жидком виде, можно в определенных пределах (выше точки плавления) изменять температуру, не изменяя числа фаз и равновесия системы. Если двухкомпонентная система находится в расплавленном состоянии (К=2, Ф=1), то имеем две степени свободы (С=2), т.е. систему бивариантную (двухвариантную). В этом случае существуют различные температуры и концентрации, при которых не изменяется число фаз и равновесие системы. Для этой же системы при наличии двух фаз (жидкой и твердой) имеем К =2, Ф=2 и С=1, т. е. с изменением температуры концентрация должна быть строго определенной.
Диаграмма состояния системы с неограниченным растворением компонентов в твердом состоянии (1 тип). По этой диаграмме (рисунок 2.4) кристаллизуются сплавы, оба компонента которых неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений. Примеры: вода и спирт, медь-никель и др.
В отличие от чистых металлов, их сплавы кристаллизуются не при постоянной температуре, а в интервале температур. Это следует из правила фаз: К =2, Ф=2, и С=1. Различные сплавы системы имеют разную температуру начала и конца кристаллизации. Верхняя кривая - линия ликвидус, а нижняя кривая - линия солидус. Выше ликвидуса сплав находится в однофазном жидком состоянии, а ниже линии солидуса - в однофазном твердом состоянии в виде твердого a -раствора. Между линиями ликвидус и солидус сплав находится в двухфазном состоянии (жидкая фаза и кристаллы твердого a -раствора).
Рассмотрим процесс кристаллизации сплава состава Ао.
Cплав выше температуры Т1 находится в жидком состоянии. При
охлаждении сплава до температуры Т1 из жидкого сплава
начинает выпадать кристаллы твердого a-раствора. При этом
состав первых кристаллов определится горизонтальной прямой, проведенной
до пересечения с линиями солидус и ликвидус. Линии, соединяющие составы фаз,
находящиеся в равновесии при данной температуре, называют конодами. Конода позволяет определять
концентрацию и количество  сосуществующих
фаз при данной температуре.
сосуществующих
фаз при данной температуре.
Точка a1 фиксирует концентрацию твердой фазы, а точка S1 - концентрацию жидкой фазы. При температуре Т2 состав твердой фазы соответствует точке a2, а жидкой фазы - S2. При температуре Т3, когда затвердевает последняя капля жидкого сплава, концентрация твердой фазы определяется точкой a3 на диаграмме состояния, а жидкой фазы - S3.
Структура любого сплава в этой
системе представляет собой зерна твердого раствора и внешне не отличается от
структуры чистого металла.
Рисунок 2.4. Диаграмма состояния
двухкомпонентной системы с неограниченной
растворимостью компонентов в твердом и жидком состояниях
Таким образом, состав фаз в процессе кристаллизации непрерывно изменяется: жидкой - по линии ликвидус, твердой - по линии солидус. Оси кристаллов, выросшие в первый момент кристаллизации, обычно обогащены тугоплавким компонентом, а междуосные пространства заполняются позже и обогащаются более легкоплавким компонентом. Неоднородность отдельных кристаллов сплава по составу называют внутрикристаллической, или дендритной ликвацией. Дендритная ликвация может быть устранена последующим длительным нагревом.
По диаграмме состояния этого типа кристаллизуются сплавы Cu-Ni, Cu-Au, Ag-Au, Fe-Cr, Bi-Sb и др.
Диаграмма состояния с полной растворимостью компонентов в жидком и ограниченной растворимостью в твердом состояниях (2 тип). По этой диаграмме (рисунок 2.6) кристаллизуются сплавы, оба компонента которых неограниченно растворимы друг в друге в жидком состоянии, обладают ограниченной растворимостью в твердом состоянии, образуют эвтектику и не образуют химических соединений. Рассмотрим это на примере системы свинец-олово.
Линия ликвидус состоит из двух ветвей. Выше ликвидуса
сплав находится в жидком состоянии. Линия солидус
состоит из трех частей: левая и правая ветви и эвтектическая горизонталь.
Ниже солидуса сплав находится в твердом состоянии. По левой ветви ликвидуса
кристаллизуются твердый a -раствор
(олово в свинце), по правой - твердый b
-раствор (свинец в олове). Под левой ветвью солидуса существует область
твердого a -раствора, а под правой -
твердого b -раствора. Взаимная
растворимость свинца и олова в твердом состоянии ограничивается указанными
областями, причем предельная растворимость олова в свинце равна 19%, а свинца в
олове - 2,5%. С понижением температуры взаимная растворимость компонентов
уменьшается. Линии, определяющие предельную растворимость компонентов друг в
друге, называют сольвус. В сплавах, концентрации которых
находятся под линиями сольвус, при температурах ниже сольвус выделяются
вторичные фазы aII
и bII.
Все сплавы, концентрация которых
находится в пределах 19% -97,5% олова находятся под эвтектической горизонталью
и в структуре содержат эвтектику (Е)- смесь твердых растворов a+b
концентрации 61,9% Sn.  Эвтектический
сплав концентрации 61,9% Sn кристаллизуется одновременным выделением двух
твердых фаз: a-твердый раствор,
состоящий из свинца и 19% олова и b-твердый раствор, состоящий из олова и
2,5% свинца. Эвтектическая реакция протекает по схеме:
Эвтектический
сплав концентрации 61,9% Sn кристаллизуется одновременным выделением двух
твердых фаз: a-твердый раствор,
состоящий из свинца и 19% олова и b-твердый раствор, состоящий из олова и
2,5% свинца. Эвтектическая реакция протекает по схеме:
Ж
61,9 Û a19
+ b97,5 ,
то есть, в равновесии находятся три фазы: жидкая и две твердые. Число степеней свободы С=2-3+1=0, следовательно, сплав эвтектического состава кристаллизуется при постоянной температуре и при постоянном соотношении реагирующих фаз. На кривой охлаждения при температуре эвтектики (для данной системы 183оС) будет горизонтальная площадка.
Доэвтектические сплавы (19-61,9%) имеют структуру a +Е, заэвтектические сплавы (61,9 –97,5%) - b +Е.
Рисунок 2.6. Диаграмма состояния системы свинец-олово
Таким образом, в этой системе возможны 4 типа структур: 1) a или b-твердый раствор, 2) a или b-твердый раствор с частицами вторичных фаз aII или bII, 3) эвтектическая смесь Е (a+b), 4) первичные кристаллы a или b и эвтектика Е.
По диаграмме этого типа затвердевают также сплавы Cu-Ag, Сu-Р, Sn-Si, Al-Li и др.
Диаграмма
состояния с образованием устойчивого химического
соединения (3 тип).
По этой диаграмме кристаллизуются сплавы, оба компонента которых
неограниченно растворимы друг в друге в жидком состоянии, а при затвердевании
образуют устойчивое  химическое
соединение.
химическое
соединение.
Диаграмма состояния сплава магний-кальций приведена на рисунке 2.7. Линия СGHМ соответствует химическому соединению Мg4Са3 и разделяет диаграмму состояния на две части. Если условно химическое соединение принять за отдельный компонент системы, то диаграмму состояния можно разделить на две диаграммы: Мg - Мg4Са3 и Мg4Са3 - Са. Каждая из них представляет собой самостоятельную диаграмму состояния, которую можно анализировать отдельно.
По диаграмме состояния IV типа кристаллизуются сплавы Мg-Zn, Мg-Cu, Fe-Nb, Мg-Sn и др.
Рисунок 2.7. Диаграмма состояния системы Mg- Ca
Связь свойств
сплавов с типом диаграмм состояния
По диаграммам состояний сплавов можно определить их структуру. Следовательно, между типом диаграммы состояния и свойствами сплава существует определенная связь.
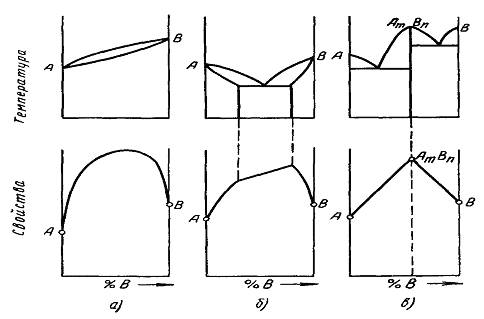
Рисунок 2.8. Изменение свойств сплавов в зависимости от типа диаграммы
состояния
На рисунке 2.8 приведены диаграммы состояния основных типов и соответствующие им закономерности изменения свойств сплавов в зависимости от концентрации. По осям ординат нижних диаграмм откладывают показатели свойств (предел прочности, твердость, электросопротивление и др.), а по осям абсцисс - концентрацию сплава.
Свойства сплавов, затвердевающих по диаграмме состояния 1 типа (рисунок 2.8, а), изменяются по кривой линии. Это связано с тем, что вследствие искажения кристаллической решетки растворителя твердый раствор имеет более высокую прочность и твердость, чем исходные компоненты. Следовательно, однородные твердые растворы характеризуются повышенными значениями твердости и предела прочности. При этом высокие прочностные свойства обычно сочетаются с достаточно высокой пластичностью. Поэтому сплавы, образующие однородные твердые растворы, обычно легко обрабатываются давлением (прокаткой, ковкой, штамповкой). Однако они обладают невысокими литейными свойствами. Образование твердых растворов всегда приводит к увеличению электросопротивления.
При образовании твердых растворов с ограниченной растворимостью, кристаллизующихся по диаграмме состояния 2 типа (рисунок 2.8, б), свойства однофазных твердых растворов изменяются по кривой линии, а свойства смесей двух фаз - по прямой. Литейные свойства сплавов, образующих твердые растворы с ограниченной растворимостью, зависят от интервала температур кристаллизации: чем больше этот интервал, тем меньше жидкотекучесть сплава и тем больше его склонность к ликвации.
Однофазные сплавы твердых растворов с ограниченной растворимостью обладают высокой пластичностью и хорошо прокатываются, куются, прессуются. Но при появлении в структуре эвтектики пластичность резко снижается. Поэтому для деформируемых сплавов, затвердевающих по диаграмме состояния 3 типа, максимум растворимости при эвтектической температуре является верхним пределом содержания компонентов.
Сплавы, имеющие двухфазную структуру твердых растворов, взаимная растворимость которых практически не изменяется при высокой температуре, весьма устойчиво сохраняют при высокой температуре твердость и прочность. Эти сплавы применяют в качестве жаропрочных материалов.
Характерной особенностью свойств сплавов, кристаллизующихся по диаграмме состояния 4 типа является большая твердость, повышенная хрупкость, малая способность к пластической деформации и высокое злектросопротивление.
Особенно резко повышается твердость, при образовании химического соединения некоторых металлов с углеродом и азотом. Карбиды вольфрама, ванадия, титана, железа обладают весьма большой твердостью, в то время как сами чистые металлы имеют низкую твердость. Поэтому подобные химические соединения широко применяют для изготовления режущего инструмента.
На примере любого типа диаграмм состояния видно, что количественные изменения концентрации (состава) сплавов приводят к качественным изменениям их свойств.
Таким образом, зная связь между свойствами сплавов и типом диаграмм состояния, можно предвидеть изменение свойств в зависимости от изменения состава сплава. Важна и обратная задача - по виду кривой какого-либо свойства определить возможный тип диаграммы состояния сплава.
2.3 Диаграмма состояния железо-углерод
Компоненты и фазы в сплавах железа с углеродом. Превращения в системе железо-углерод. Микроструктура сталей.
Диаграмма железо- углерод, имеющая техническое применение, включает содержание углерода от 0 до 6,67% (Рисунок 2.9).

Рисунок 2.9. Диаграмма состояния железо-углерод
При содержании углерода 6,67% образуется химическое соединение Fe3C, называемый цементитом. Таким образом, рассматриваемая часть диаграммы железо- углерод представляет часть диаграммы между чистым компонентом А (Fe) и химическим соединением А3В (Fe3C). Диаграмма является двойственной: сплошные линии соответствуют метастабильной системе Fe- Fe3C, пунктирные линии изображают стабильную систему Fe - C. В области до 4,3% С различия граничных фазовых линий между метастабильной и стабильной системами незначительны. Однако при длительном температурном воздействии и при более высоком содержании углерода цементит имеет склонность к распаду на железо и графит. Графит и цементит могут, как часто наблюдается у чугуна, появляться рядом друг с другом.
Компоненты и фазы в сплавах железа
с углеродом
Железо и углерод являются полиморфными элементами.
Железо имеет температуру плавления 1539оС, и имеет две полиморфные модификации. a -Fe, существующий при температурах до 911оС и от 1392 до 1539оС, имеет ОЦК решетку. Оно ферромагнитно до температуры 768оС (точка Кюри). g -Fe, существующий в интервале температур 911 - 1392оС, имеет ГЦК решетку и парамагнитно.
Углерод существует в двух модификациях: графит и алмаз. Алмаз в системе железо-углерод не встречается. Графит имеет слоистую ГП решетку. Между атомами углерода каждого слоя действую сильные ковалентные связи, которые осуществляются спариванием трех валентных электронов. Четвертые валентные электроны углерода переходят в коллективные, образуя металлическую связь. Поэтому графит имеет металлические свойства, как блеск и электропроводность. Между слоями действуют слабые поляризационные связи.
В равновесной системе Fe-C (Fe-Fe3C) имеются пять фаз: жидкая фаза и четыре твердые фазы.
Феррит – твердый раствор внедрения углерода в a -Fe. Поскольку a -Fe существует в двух температурных интервалах, феррит, существующий при температурах до 911оС, называется a -феррит, а феррит существующий при температурах от 1392 до 1539оС - d -феррит. Растворимость углерода в феррите мала: в a -феррите растворяется 0,006% С при комнатной температуре и предельная растворимость 0,025% - при температуре 727оС; в d -феррите растворяется до 0,01 % углерода. Феррит мягкая, пластичная фаза со следующими свойствами: sВ=300 МПа, d=40%, y=70%, KCU=2,5 МДж/м2, НВ 800-1000.
Аустенит - твердый раствор внедрения углерода в g -Fe. Растворимость углерода в аустените больше: предельная растворимость 2,14% при температуре 1147оС, уменьшается до 0,8% при температуре 727 оС. Аустенит - высокотемпературная фаза.
Цементит – карбид железа Fe3C, химическое соединение практически постоянного состава. Содержит 6,67% вес (31% ат.) углерода, имеет сложную орторомбическую решетку, в элементарной ячейке которой 12 атомов железа и 4 атома углерода. Цементит тверд (НВ 8000) и хрупок.
Графит – углерод, выделяющийся в свободном состоянии. Фаза химически стойкая, но малопрочная.
Превращения в системе
железо-углерод
Диаграмма Fe-Fe3C является характерным примером сложной системы, содержащей три превращения:
1. Перитектическое превращение (линия HJB) с перитектической точкой при 0,16%С и 1493оС (точка J), в результате чего из расплава и первично выделенного d-твердого раствора (ОЦК) образуется g -твердый раствор (ГЦК) по реакции: Ж 0,51 + d0,1 ® g0,16.
2. Эвтектическая реакция (линия ECF) между расплавом, g-твердым раствором и Fe3C (С) по реакциям:
при 4,3% С и 1147оС Ж 4,3® g2,14+Fe3C 6,67 (точка С), метастабильная диаграмма,
при при 4,25% С и 1153оС Ж 4,25® g2,06+ C (точка С’) стабильная диаграмма.
Эвтектическая горизонталь простирается от 2,14 (2,06) до 6,67% С, соответственно от 31 до 100% Fe3C.
3. Эвтектоидное превращение g - твердого раствора (аустенит) в a + Fe3C при 0,8%С и 723оС по реакции:
g0,8 ® a0,025 + Fe3C 6,67 (точка S).
Эвтектоидная смесь феррита и цементита, образовавшаяся по этой реакции, называется перлитом.
При очень медленном охлаждении или длительной
выдержке при температуре 738оС возможна реакция по стабильной диаграмме g0,69 ® a0,025 + C (точка S’).
При содержании углерода 2,14 – 4,3%- наряду с первично выделенным g - твердым раствором (аустенитом) или при 4,3 – 6,67% С - первично выделенным цементитом, оставшийся расплав при температуре 1147оС кристаллизуется в эвтектику (g + Fe3C), которая называется также ледебуритом.
С максимальной растворимостью углерода в g-твердом растворе при 2,14% связываются границы для стали (<2,14%) и чугуна (>2,14%). Как видно из диаграммы, стали не испытывают эвтектического превращения.
По микроструктуре в отожженном состоянии различают:
а) техническое железо, не испытывающее эвтектоидное превращение (до 0,025%С);
б) доэвтектоидные стали (от 0,025 до 0,8%С);
в) эвтектоидные стали (0,8 %С);
г) заэвтектоидные стали (от 0,8 до 2,14%С).
В техническом железе (Рис. 2.10) микроструктура состоит либо только из равноосных зерен феррита (до 0,006%С), либо из равноосных зерен феррита с пограничными выделениями третичного цементита. Третичный цементит образуется по границам зерен феррита вследствие уменьшения растворимости углерода в феррите при понижении температуры, и образует разорванную сетку, т.к. количество его невелико.
В доэвтектоидных сталях две структурные составляющие: избыточный феррит, образующийся в результате полиморфного превращения g ®a, и эвтектоид - перлит, который возникает при эвтектоидном превращении: g08®a0.025+Fe3C. Избыточный феррит при большом его количестве выделяется в виде равноосных зерен (рисунок 2.11), при малом количестве - в виде сетки по границам зерен аустенита (рисунок 2.13).
Перлит имеет характерное пластинчатое строение и состоит из отдельных зерен - колоний (рисунок 2.12). Количественное соотношение феррита и цементита в перлите постоянно, не зависит от состава стали и составляет PK/PS=7,3:1.
В заэвтектоидных сталях структурные составляющие - перлит и цементит вторичный. Последний выделяется из аустенита перед эвтектоидной реакцией из-за уменьшения растворимости углерода при понижении температуры. Вторичный цементит выделяется по границам зерен аустенита, образуя сетку (рисунок 2.14), заполненную колониями перлита, которые образуются из аустенита при эвтектоидном превращении.
|
Рисунок 2.10 - Схема микроструктуры технического
железа: феррит и третичный цементит по границам зерен |
Рисунок 2.11 - Схема микроструктуры доэвтектоидной
стали: зерна избыточного феррита и перлит |
Рисунок 2.12 -
Схема микроструктуры перлита |
|
Рисунок 2.14 - Схема микроструктуры доэвтектоидной стали: сетка избыточного феррита и перлит |
Рисунок 2.14 - Схема микроструктуры заэвтектоидной
стали: сетка вторичного цементита и перлит |
Рисунок 2.15 - Схема
микроструктуры заэвтектоидной стали: феррит и глобулярный (зернистый)
цементит
|
В таблице 2.1 приведены данные о фазовых и структурных составляющих сталей.
Таблица 2.1 - Фазовое состояние и микроструктура отожженных углеродистых сталей
|
Техническое название
сплава |
% С (по массе) |
Фазы при 20оС |
Структурные составляющие
при 20оС |
|
Техническое железо |
0 - 0,006 0,006-0,025 |
a , Fe3C |
Феррит (Ф) Ф+ЦIII |
|
Доэвтектоидная сталь |
0,025 - 0,8 |
a , Fe3C |
Перлит+ФИЗБ |
|
Эвтектоидная сталь |
0,8 |
a , Fe3C |
Перлит |
|
Заэвтектоидная сталь |
0,8 - 2,14 |
a , Fe3C |
Перлит + ЦII |
Фазы углеродистой стали отличаются механическими свойствами: феррит мягок и пластичен, цементит тверд и хрупок. Ясно, что механические свойства стали зависят от свойств фаз, однако существенное влияние оказывает и микроструктура. Свойства отдельных фаз и перлита можно сравнить в таблице 2.2. Эвтектоидные и заэвтектоидные стали со структурой перлита или перлита с вторичным цементитом обладают повышенной твердостью. Если же сталь подвергнуть специальному отжигу (сфероидизирующий отжиг), выделения вторичного цементита и цементит эвтектоида принимают глобулярную форму (см. рисунок 2.15), а твердость стали снижается.
Таблица 2.2 - Механические свойства структурных составляющих в углеродистых сталях
|
Структура (фаза) |
Механические свойства |
||
|
|
Твердость НВ, МПа |
s В, МПа |
d ,% |
|
Феррит Цементит Перлит Феррит и зернистый цементит (0,8%С) |
800 - 900 7500 - 8200 1900 - 2300 1600 - 1900 |
190 - 250 30 830 - 900 650 - 700 |
40-50 <1 9-12 18-25 |
Вопросы для самопроверки к главе
2
2. Может ли лед начать таять при температуре 0оС?
3. Что обуславливает переход вещества из одного фазового состояния в другое?
4. Какой признак на кривой охлаждения определяет температуру кристаллизации чистых металлов?
5. В чем сущность процесса модифицирования?
8.
Какие фазы присутствуют в сплавах системы
Fe-Fe3C (Fe - C) при
комнатной температуре?
9.
Какие фазы имеются в равновесной системе
Fe-Fe3C (Fe-C)?
10.
По какому принципу сплавы системы Fe-Fe3C
(Fe-C) подразделяются на стали и чугуны?
11.
Чем отличаются белый и серый чугун?
12.
Чем отличается ледебурит при температурах
выше и ниже 727оС?





